Adjuvanzien – ihre Bedeutung für Impfstoffe
Es ist nun mehr als 80 Jahre her, seit Wissenschaftler entdeckten, dass Aluminiumhydroxid ein effektives Adjuvanz und für etliche Impfstoffe unentbehrlich ist. Seitdem hat sich in der Entwicklung neuer Adjuvanzien einiges getan und so stehen heute weitere Adjuvanzsysteme zur Verfügung, um die Immunantwort zu verbessern und in die gewünschte Richtung lenken zu können. Die Immunogenität und damit Effektivität einer Impfung können so erhöht werden. Dieser Artikel gibt einen Überblick über die Adjuvanzsysteme, welche bereits in Impfstoffen verwendet werden und gibt einen Ausblick auf zukünftige Entwicklungen.
1. Was sind Adjuvanzien?
Adjuvanzien, auch Wirkverstärker genannt, sind Substanzen, welche einigen Impfstoffen hinzugefügt werden müssen, um deren Immunogenität so zu steigern, dass es zu einer effektiven Immunantwort gegen das Antigen kommt. Das klassische Adjuvanz ist Aluminiumhydroxid, welches in vielen Impfstoffen noch heute seine Wirksamkeit entfaltet.
Es war Gaston Ramon, ein französischer Veterinärmediziner und Direktor des Pasteur Instituts, welcher in den 1920er Jahren Aluminiumsalze als Wirkverstärker den Impfstoffen beifügte. Sein Ziel war es, bei Pferden, die gegen Tetanus oder Diphtherie geimpft wurden, die Menge an Antigen-spezifischen Antikörper zu erhöhen und somit die Wirksamkeit des Pferdeserums für den Schutz von Menschen wesentlich zu verbessern. Es zeigte sich eine bessere Immunogenität bei nur geringfügig höherer Reaktogenität.1
Fortschritte in der immunologischen Grundlagenforschung haben zur Entwicklung einer neuen Generation von Adjuvanzien geführt, die die Immunreaktion gegen die Antigene des Impfstoffs optimieren und einen besseren Schutz liefern als klassische Impfstoffe. Durch die Kombination von mehreren solcher Adjuvanzien entstehen so genannte Adjuvanzsysteme. Dadurch kann die Immunantwort gezielt beeinflusst und die Wirksamkeit von Impfstoffen wesentlich verbessert werden. Bessere Einsichten in die Arbeitsweise des Immunsystems, z.B. zu den Wechselwirkungen von angeborenem und erworbenem Immunsystem, haben eine planvollere Entwicklung von Impfstoffen ermöglicht.
Adjuvanzsysteme wurden entwickelt, um den Impfschutz gegen Krankheiten wirksamer oder länger anhaltend zu machen, als dies mit klassischen Adjuvanzien möglich ist – oder aber bei bestimmten Erkrankungen einen Impfschutz überhaupt erst möglich zu machen. Dies gilt beispielsweise für bestimmte Patienten (z.B. mit einem geschwächten Immunsystem) oder gegen besonders komplexe Erkrankungen. Ziel dabei ist es, eine synergistische Wirkung des jeweiligen Antigens und des Adjuvanzsystems zu erreichen, um so die Reaktion des Immunsystems auf den Impfstoff zu optimieren. Dies muss für jeden neuen Impfstoff und jede Erkrankung neu angepasst und entwickelt werden. Die Forscher wählen daher für jeden Impfstoff das am besten geeignete Adjuvanzsystem. Zugrunde liegende Kriterien sind dabei die jeweilige Erkrankung, die Bevölkerungsgruppe, die geimpft werden soll, das Antigen, die Art der Verabreichung, die Art der gewünschten Immunreaktion und die erforderliche Dauer des Impfschutzes.
Die folgenden Adjuvanzsysteme werden momentan in zugelassenen Impfstoffen verwendet: Tabelle 12
Adjuvanz |
Komponenten |
Impfstoffe |
MF59 |
Squalen; Polysorbat 80; sorbitol trioleat |
Saisonale Influenza Pandemische Influenza Vogel-Grippe |
AS03 |
Squalen; α-tocopherol; polysorbat 80 |
Pandemische Influenza; Vogel-Grippe |
AS01 |
MPL (Monophosphoryl-Lipid A), Quillaja saponaria Molina, Fraktion 21 QS-21; Liposomen |
Herpes Zoster Malaria tropica |
AS04 |
MPL (Monophosphoryl-Lipid A), Aluminium-hydroxide |
Hepatitis B Virus Humanes Papillomavirus |
IC31 |
Peptid KLK, Oligodesoxynukleotid ODN1 |
Nur in experimentellen Impfstoffen, bisher nicht zugelassen |
Iscomatrix |
QS21, Cholesterol, Phospholipide, Bildung von 40-50nm großen Käfigstrukturen |
Nur in experimentellen Impfstoffen, bisher nicht zugelassen |
Virosomen |
Doppelmembran (Liposomen), Einfügung von viralen Antigenen |
Hepatitis A |
Aluminiumhydroxid, Aluminiumphosphat |
Aluminiumhydroxid, Aluminiumphosphat |
Tdap, Tdap-Polio, FSME, Tollwut, Japanische Enzephalitis, Hepatitis A & B, 6/5fach Impfstoffe im pädiatrischen Bereich, Humanes Papillomavirus |
CpG-Oligonukleotid |
DNA-Sequenz mit CpG Motiven |
Hepatitis B, COVID -19 |
2. Welche Adjuvanzien gibt es und was leisten diese?
Aluminiumhydroxid wird als Adjuvanz schon seit vielen Jahrzehnten erfolgreich verwendet und findet sich in vielen Totimpfstoffen, wie z.B. im Kombinationsimpfstoff gegen Tetanus, Diphtherie und Pertussis (Tdap), in den Impfstoffen gegen Hepatitis A, Hepatitis B, Japanische Enzephalitis und frühsommerliche Meningoenzephalitis (FSME) sowie in den Dreifach-, Fünffach- und Sechsfach-Impfstoffen für den Säuglingsbereich. Sämtliche Lebendimpfstoffe dagegen, wie z.B. die Impfungen gegen Masern, Mumps, Röteln, Varizellen, Rotaviren, und Gelbfieber benötigen keine Adjuvanzien, weil hier ein abgeschwächter lebenden Erreger durch seine Replikation im Körper des Impflings eine starke Immunantwort auslöst1, 2.
Aluminiumhydroxid selbst induziert eine starke, sogenannte Th2-Immunantwort, die in einer B-Zell-Antwort mündet. Diese wiederum führt zu hohen Antigen-spezifischen Antikörperkonzentrationen, welche zum großen Teil für den Schutz vor dem Krankheitserreger verantwortlich sind3.
Aluminium ist das dritthäufigste Element auf unserem Planeten und findet sich in natürlicher Weise im Boden, in Pflanzen und in diversen Speisen sowie im Trinkwasser. Babynahrung und Muttermilch enthalten auch Aluminium, wobei Babymilch 226 µg/Liter und Muttermilch 14-34 µg/Liter an Aluminium beinhalten4.
Es gibt zahlreiche Untersuchungen dazu, ob Aluminium in Impfstoffen zu neurotoxischen Schäden oder gar Alzheimer führen könnte. Aluminium wird seit über 90 Jahren in Impfstoffen verwendet und es sind Millionen an Dosen verabreicht worden, ohne dass es zu gesundheitlichen Auswirkungen gekommen ist4.
Die Schlussfolgerung einer aktuellen Studie sowie zahlreicher anderer wissenschaftlicher Studien ist: Die Konzentration des in Impfstoffen enthalten Aluminiums ist bedeutend geringer als eine neurotoxische Dosis. Es gibt deshalb keine Gründe für die Elimination von Aluminium aus den Impfstoffen aus Angst vor Neurotoxizität5.
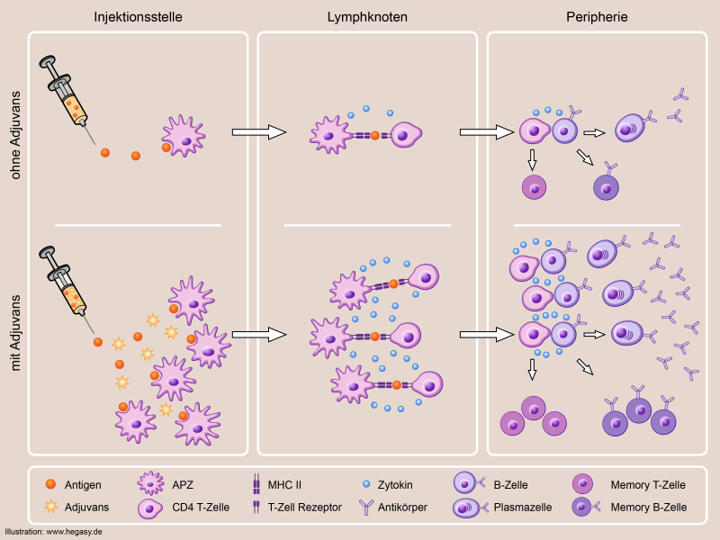
Abb. 1: Passive und aktive Immunisierung
Seit es Leben auf diesem Planeten gibt, existiert ein Wettstreit zwischen den Lebewesen und somit auch zwischen Krankheitserregern und deren Wirten. Die Krankheitserreger benötigen die Wirte, um sich mit ihrer Hilfe erfolgreich zu vermehren und ihr Genom an die nächste Generation weiterzugeben. Auf der anderen Seite stehen die vom Krankheitserreger „benutzten“ Lebewesen, welche mit ihrer Immunabwehr genau dieses verhindern möchten.
In diesem Wettstreit haben die von den Krankheitserregern befallenen Lebewesen sogenannte „Pattern recognition receptors“ (PRR) entwickelt. Diese Rezeptoren auf den Zellen des Immunsystems können Strukturen bei den Krankheitserregern erkennen, welche seit Millionen von Jahren in deren Struktur und im Genom konserviert sind. Diese konservierten Strukturen nennen sich „Pathogen associated molecular patterns“ (PAMPS). Eine wichtige Gruppe der sogenannten PRR sind die „toll like Rezeptoren“ (TLR). Diese TL-Rezeptoren sind sehr gut charakterisiert und wir wissen, dass gewisse TL-Rezeptoren von bestimmten PAMPS aktiviert werden und daraufhin die Immunantwort in eine bestimmte Richtung lenken1. Ich möchte die Wirkweise der neuen Adjuvanzien an Beispielen erläutern.
Erstes Beispiel: Bakterielle Membranen sind ein starker Induktor für eine forcierte inflammatorische Immunantwort, eine sogenannt Th1-Immunantwort über den TLR-4. Diesen Mechanismus macht man sich zu Nutze, in dem Adjuvanzsysteme wie AS01 und AS046 das bakterielle MPL (Monophosphoryl-Lipid A) beifügt ist und somit genau diesen Effekt induziert.
Zweites Beispiel: Die Substanz Squalen, die in den Adjuvanzien MF59 und AS03 enthalten ist, induziert eine Öl-in-Wasser-Emulsion. Diese führt zu einer wesentlich verbesserten Aufnahme der im Impfstoff enthaltenen Antigene über die Lipidmembran der Makrophagen und dendritischen Zellen, die durch die lipophile Beschaffenheit ihrer Zellmembran lipophile Partikel besser aufnehmen als rein wässrige Phasen. Squalen kommt in der Natur in vielen Pflanzen und Tieren sowie im Menschen als Hautlipid und im Blutserum vor. Aber auch pflanzliche Öle (Olivenöl) und Fische enthalten dieses Naturprodukt1.

Abb. 2: Liposomen, 100nm Durchmesser, wässriger Kern, Phospho-Lipid Doppelmembran
Öl-in-Wasser-Emulsionen dienen dem Zweck, ein fettlösliches Antigen mit Hilfe der Emulsion in eine wässrige Phase zu bekommen und damit eine bessere Aufnahme in die Makrophagen und dendritischen Zellen zu erzielen. Eine wichtige Substanz für eine Emulsion ist MF59, welches im Grippeimpfstoff für ältere Menschen eingesetzt wird. Ein gutes Beispiel für eine natürliche Emulsion ist Milch, hier werden auch fettlösliche Substanzen in einer wässrigen Lösung gehalten.
Drittes Beispiel: Im Adjuvanzsystem AS01 ist neben dem schon beschriebenen Monophsophoryllipd auch noch Quillaja saponaria Molina, Fraktion 21, genannt QS-21 enthalten. Dieses ist ein Seifenderivat aus der Rinde des chilenischen Seifenbaumes Baumes Quillaja saponaria. Der Effekt, der damit erzielt wird, ist dem eines Detergens gleich zu setzten, welches es ermöglicht fettige Substanzen in einer wässrigen Lösung zu halten.
Alpha Tocopherol ist im Adjuvanzsystem AS03 enthalten und ist auch unter dem Namen Vitamin E bekannt. Vitamin E ist lipidlösliches Antioxidans und ein wichtiger Bestandteil des menschlichen Körpers und Stoffwechsels. Eine wichtige Aufgabe des Vitamin E ist es, die physikalische Stabilität der Zellmembran zu gewährleisten und sie als Antioxidans vor Oxidation zu schützen. Vitamin E wird in hohen Mengen ausschließlich in Pflanzen produziert1, 2.
Vitamin E bewirkt eine beschleunigte Rekrutierung von Immunzellen an die Applikationsstelle des Impfstoffes und eine bessere Aufnahme des Antigens7.
Abschließendes Beispiel ist das Oligonukleotid CpG, welches als Motiv in bakterieller und viraler DNA sehr häufig vorkommt und bei den Wirbeltieren im Genom unterrepräsentiert ist. Über TLR-9 wird ein starker Immunstimulus getriggert. In einem COVID-Impfstoff und einem Hepatitis B-Impfstoff findet dieses Adjuvanzsystem Anwendung8.
3. Warum benötigen wir neue Adjuvanzsysteme?
Aluminiumsalze funktionieren bei den traditionellen bakteriellen Toxinen als Wirkverstärker effektiv, da hier der Schutz hauptsächlich durch spezifische Antikörper, welche gegen die Toxine gerichtet sind, erzeugt wird. Sobald aber komplexere Immunantworten, auch z.B. gegen intrazellulär agierende Erreger notwendig werden, sind Aluminiumsalze nicht mehr zielführend.
Neben dem altbewährten Aluminiumhydroxid gibt es aus diesem Grunde weitere Adjuvanzien. In diesem Abschnitt möchte ich konkret anhand der Impfstoffe, die die oben beschriebenen Adjuvanzien enthalten, ihren jeweiligen Effekt skizieren.
AS04 besteht aus 3-O-Desacyl-4’-monophosphoryl-Lipid A (MPL) und Aluminiumhydroxid. Es stimuliert vor allem die Th1-Zell-Komponenten der Immunantwort. Somit wird eine hohe und anhaltende Immunantwort erzielt, welche hohe Antikörpertiter durch eine starke Stimulation der Antikörper-produzierenden B-Zellen induziert. Bei dem Impfstoff gegen die Humanen Papillomaviren ist eine gute T-Zellantwort unentbehrlich für hohe spezifische Antiköper gegen HPV 16 und 18. Durch dieses starke Adjuvanzsystem wird eine so forcierte Immunantwort stimuliert, dass eine Kreuzprotektion auch gegen die nicht im Impfstoff enthaltenen Papillomaviren 31, 33 und 45 erzielt wird.
Bei Dialysepatienten und einer Impfung gegen Hepatitis B, welche durch ihre Urämie eine per se schlechtere Immunantwort haben, bewirkt dieses Adjuvanzsystem, dass ein effektiver Impfschutz gegen Hepatitis B aufgebaut werden kann.
Das Adjuvanzsystem AS01B besteht aus dem Pflanzenextrakt von Quillaja saponaria Molina, Fraktion 21 (QS-21) und 3-O-Desacyl-4’-monophosphoryl-Lipid A (MPL) aus Salmonella minnesota. Dieses Adjuvanz wird im Impfstoff gegen Gürtelrose und im Impfstoff gegen die Malaria tropica verwendet. Bei dem Impfstoff gegen Gürtelrose bewirkt das Adjuvanz, dass es zu einer langanhaltenden und hohen Immunantwort gegen das Antigen „Glyloprotein E“ kommt, und damit ein hoher Schutz von über 90% in sämtlichen Altersgruppen jenseits des fünfzigsten Lebensjahres gegen Herpes Zoster erreicht wird.
Der Impfstoffgegen die Malaria tropica, welcher in einigen ausgewählten Gebieten Afrikas bei Kindern eingesetzt wird, ist der bislang erste Impfstoff, der es zu einer Zulassung nach Standards der Europäischen Arzneimittelagentur (EMA) für die Reduktion der hohen Kindersterblichkeit an Malaria tropica in Afrika geschafft hat. Hier ist das Adjuvanzsystem wichtig, um eine T-Zell gerichtete spezifische Immunreaktion gegen die Leberstadien von Plasmodium falciparum zu erzielen2.
Es lässt sich zusammenfassen, dass die neueren Adjuvanzsysteme jenseits des Aluminiumhydroxids insbesondere darauf abzielen die Immunantwort mehr in eine T-Zell gerichtete Immunabwehr, eine sogenannte Th1-Immunantwort, zu lenken. Dieses ist vor allen Dingen bei intrazellulären Erregern sehr wichtig1.
4. Zukünftige Rolle von Adjuvanzien
Ein Beispiel für einen Impfstoff in der Entwicklung ist die Impfung gegen nicht-typisierbare Haemophilus influenzae (NTHI) und Moraxella catarrhalis, welche beide eine große Bedeutung als Infektionserreger bei Patienten mit COPD haben. Hier wird das Adjuvanzsystem AS01 mit den drei konservierten Porteinen von nicht-typisierbar Haemophilus influenzae (Protein D und Fusionsprotein E mit Pilin A) kombiniert mit dem Protein UspA2 von Moraxella catarrhalis9.
Ein weiteres wichtiges Entwicklungsfeld sind Impfstoffe gegen Pilzinfektionen10. Hier sind Adjuvanzien wie beispielsweise das schon bekannte Monophopshorylipid, aber auch bakterielle DNA in Form von CpG-Oligodesoxynucleotide in Erprobung sowie Öl-in-Wasser-Emulsionen wie z.B. Montanide ISA5110. Ein weiteres großes Forschungsgebiet sind Impfungen gegen onkologische Erkrankungen. Hier spielen Adjuvanzien eine große Rolle. Ein Forschungsfeld ist die Entwicklung eines Impfstoffes gegen die Melanom-Antigen-Genfamilie, deren Proteine in Tumorzellen häufig exprimiert werden. Hier sind dann ausgefeilte Antikörper, Zellsysteme und Adjuvanzsysteme in der Erprobung11.
Referenzen
1. Garçon N, Leroux-Roels G, Cheng W. Understanding Modern Vaccines: Perspectives in Vaccinology, (2011) Volume 1/Issue 1/89e113
2. Giudice G, Rino Rappuolia R, Didierlaurent A M; Correlates of adjuvanticity: A review on adjuvants in licensed vaccines, Seminars in Immunology 39 (2018) 14–21
3. Marrack P, McKee AS, Munks MW. Towards an understanding of the adjuvant action of aluminium. Nature Review
4. Immunization Advisory Centre 2017, Aluminium in vaccines
5. Prinzipi N, Esposito S. Aluminum in vaccines: Does it create a safety problem? Vaccine 36 (2018) 5825–5831
6. Didierlaurent AM, Morel S, Lockman L et al. AS04, an aluminum salt- and TLR-4 agonist-based Adjuvant System, induces a transient localized innate immune response leading to enhanced adaptive immunity. J Immunol 2009;183:6186e6197
7. Morel S, Didierlaurent A, Bourguignon P et al. Adjuvant System AS03 containing alpha-tocopherol modulates innate immune response and leads to improved
adaptive immunity. Vaccine 2011;29:2461e2473
8. Krieg A.M. and Kline J.N. Immune effects and therapeutics applications of CpG motifs in bacterial DNA. In: Immunopharmacology 48, 2000, S. 303-305
9. Van Damme P, Leroux-Roels G, Vandermeulen C. et al., Safety and immunogenicity of non-typeable Haemophilus influenzae-Moraxella catarrhalis vaccine. Vaccine. 2019 May 21;37(23):3113-3122. doi: 10.1016/j.vaccine.2019.04.041
10. Portuondo DLF, Ferreira LS, Urbaczek AC et al., Adjuvants and delivery systems for antifungal vaccines: Current state and future developments, Medical Mycology, 2015, 53, 69–89
11. Schooten E, Di Maggiob A, van Bergen en Henegouwen PMP et al., MAGE-A antigens as targets for cancer immunotherapy. Cancer Treatment Reviews 67 (2018) 54–62


