IgG4 nach mRNA-basierter Impfung
In einer medial breit rezipierten Studie aus Erlangen wurde festgestellt, dass es nach wiederholter Impfung mit mRNA-basierten COVID-Impfstoffen zu einem ungewöhnlichen Klassenwechsel der gegen das SARS-CoV-2-Spikeprotein gerichteten Antikörper kommt, nämlich zu einer starken Zunahme der nicht-inflammatorischen IgG4-Subklasse. Dies führt zur Verringerung sogenannter Effektorfunktionen der gegen das Spikeprotein gerichteten Antikörper, z.B. der Komplementfixierung oder der Phagozytose Antikörper-dekorierter Partikel, was theoretisch eine Verringerung der antiviralen Wirkung der Impfung nach sich ziehen könnte.
Die Neutralisationsfähigkeit der Antikörper hingegen wird durch den Klassenwechsel nicht negativ beeinflusst. Bisher gibt es keine Hinweise, dass die beobachtete Verschiebung des Antikörperprofils hin zu IgG4 den Impfschutz in der Praxis nachteilig beeinflusst, was durch die nach wie vor sehr hohe Wirksamkeit der mRNA-basierten COVID-Impfung gegen schwere Verläufe, auch im Kontext verschiedener Omikron-Sublinien, untermauert wird.
Studie findet vermehrt SARS-CoV-2-Spike-spezifisches IgG4 nach wiederholter mRNA-Impfung
Im Dezember 2022 wurde in Science Immunology eine hoch interessante Arbeit aus Erlangen veröffentlicht, die ein breites Medienecho hervorgerufen hat.1–4 Teilweise wurde diese Studie auch in den sozialen Medien missbraucht, um Ängste vor der COVID-Impfung zu schüren. Die Autoren haben in der Studie untersucht, wie sich die Zusammensetzung der gegen das Spikeprotein von SARS-CoV-2 gerichteten Antikörper bezüglich der Immunglobulin G (IgG)-Subklassen im Laufe der Zeit nach mehrfacher Impfung mit einer der mRNA-basierten COVID-Impfungen verändert. Dabei wurde festgestellt, dass ab der zweiten Impfung vermehrt Spike-spezifisches IgG4 in den Seren der Probanden zu finden war, drastisch erhöht dann nach der dritten Impfung.
Diese Verschiebung hin zu IgG4 war noch ausgeprägter nach einem weiteren Antigenkontakt durch Durchbruchsinfektion. Dies ist ein interessanter Befund, da IgG4 sonst eher selten in hoher Menge nach Infektionen oder Impfungen gebildet wird, oder zumindest kaum Berichte dazu vorliegen. Auch in der Studie wurde keine Induktion von IgG4 durch eine Adenovirusvektor-basierte Impfung gegen SARS-CoV-2, durch die Tetanusimpfung oder durch wiederholte RSV-Infektionen festgestellt. Eine weitere Studie aus Lübeck hat kurz darauf die Befunde für zwei mRNA-Impfstoffe im direkten Vergleich mit einem adenoviralen Vektorimpfstoff bestätigt.1,5
IgG-Subklassen
Insgesamt stellt IgG4 unter 5% des gesamten IgG-Pools, bei den SARS-CoV-2-Spike-spezifischen Antikörpern waren es hingegen nach drei mRNA-basierten Impfungen knapp unter 20%, bei zusätzlicher Durchbruchsinfektion teilweise noch mehr.1,6 Generell ist es so, dass B-Zellen während der Immunreaktion unterstützt von T-Zellen einen oder auch mehrere Klassenwechsel vollziehen. Während am Anfang der Immunreaktion IgM gebildet wird, kommt es während der weiteren Reifung der B-Zelle zur Rekombination, ggfs. auch mehrfach, und ein anderes Segment, das für den konstanten Teil der schweren Kette des Immunglobulins kodiert, wird angefügt.7 Der vordere, antigenbindende Teil des Antikörpers (Fab) bleibt dabei unverändert, aber der hintere, sogenannte Fc-Teil (Abbildung 1 A), wird durch den neuen Teil der schweren Kette geändert. Das Gensegment für IgG4 kommt nach dem für IgG3, IgG1 und IgG2, alle Segmente sind auf dem Chromosom hintereinander angeordnet, die dazwischenliegenden Segmente werden bei der Rekombination deletiert oder es kommt zur Rekombination mit einem Segment auf dem anderen Chromosom der Zelle.8
Effektorfunktionen von Antikörpern
Man nimmt an, dass IgG4, dessen für den konstanten Teil der schweren Kette kodierendes Gensegment als letztes in der Reihe steht, durch langanhaltende Auseinandersetzung mit einem Antigen vermehrt gebildet wird, als Beispiel wird gerne eine IgG4 Antwort gegen Bienengift bei häufig gestochenen Imkern oder bei Allergien genannt – in beiden Fällen wirkt IgG protektiv gegen ein Überreaktion des Immunsystems.7,9 Aus dem gleichen Grund, nämlich ständiger Konfrontation mit dem Antigen, könnte IgG4 auch bei einer Reihe von Autoimmunerkrankungen sowie bei den sog. IgG4-assoziierten Erkrankungen erhöht sein.6,9 Hier bleibt nochmal klar festzuhalten, dass die gegen das Spikeprotein gerichteten Antikörper nichts mit Autoimmunerkrankungen zu tun haben. Nun ist so, dass auch mRNA-basierte Impfstoffe eine sehr lange Reaktion über mindestens sechs Monate in den Keimzentren hervorrufen, was einen Klassenwechsel bis hin zu IgG4 begünstigen könnte.10 Zudem sind beide mRNA-basierten COVID-Impfungen bei jüngeren Erwachsenen vergleichsweise hoch dosiert, wodurch eine ausreichende Wirksamkeit z.B. bei Senioren gewährleistet wird.11,12 SARS-CoV-2-Spike-reaktives IgG4 wurde auch vermehrt bei schweren COVID-Verläufen nachgewiesen, welche auch von starker und langanhaltender Präsentation viraler Antigene gekennzeichnet sind.13 Prinzipiell kann SARS-CoV-2 also auch bei langanhaltender „natürlicher“ Infektion einen Klassenwechsel der gegen das Spikeprotein gerichteten B-Zellen hin zu IgG4 auslösen.
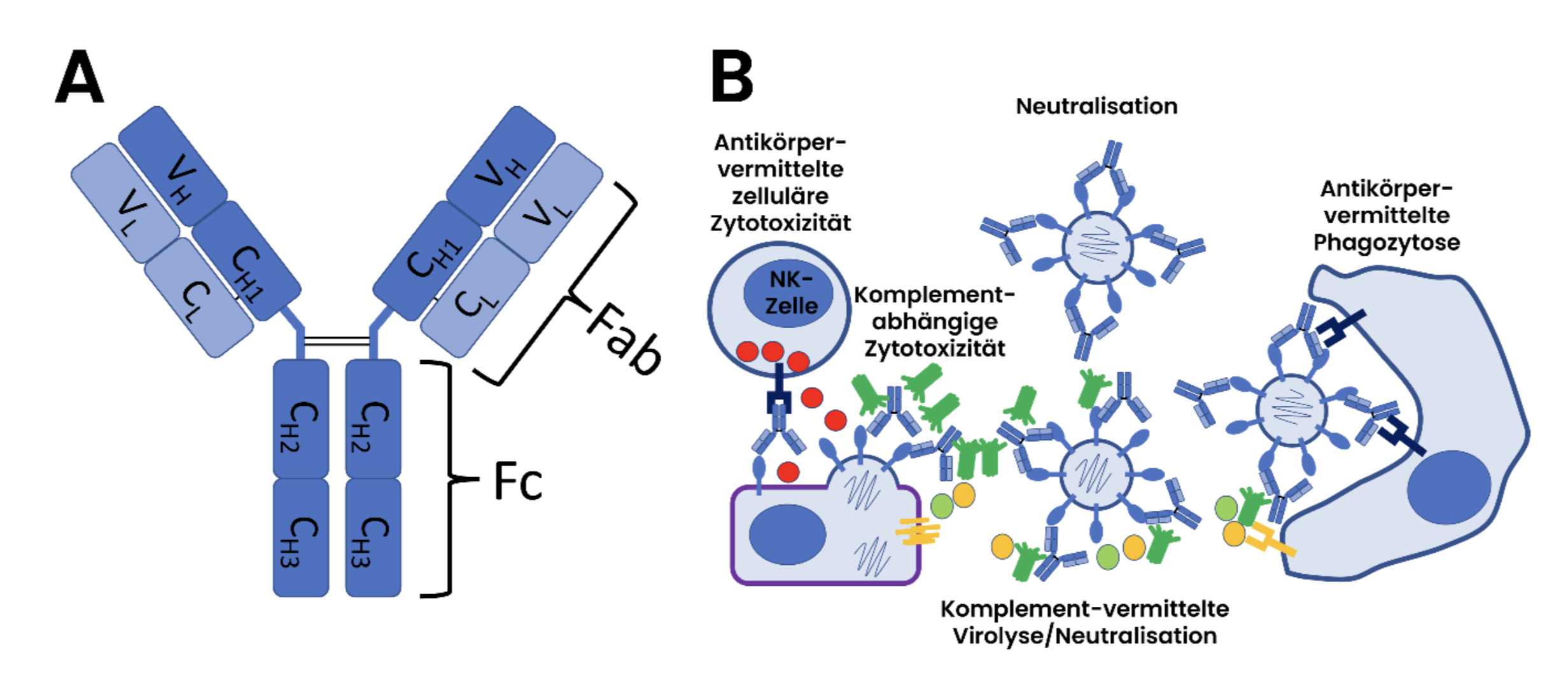
Abb. 2: A) Struktur eines IgG Antikörpers. B) Schematische Darstellung antiviraler Effektorfunktionen durch Antikörper.14,16,18
Die verminderte Effektor-Funktionalität von IgG4 als „letzter“ zur Verfügung stehenden IgG-Subklasse bei fortgesetztem Klassenwechsel erscheint physiologisch einleuchtend – es ist zu vermuten, dass eine fortwährende stark entzündlich wirkende Immunantwort gegen ein dauerhaft präsentes oder immer wiederkehrendes Antigen nachteilig ist.
Tabelle 1: Übersicht über eine Auswahl unterschiedlicher Effektorfunktionen der IgG-Subklassen.14,15,19,20
IgG1 |
IgG2 |
IgG3 |
IgG4 |
|
Phagozytose (Zelltypabhängig, hier wie beispielhaft auf THP-1 Zellen gemessen) |
++ |
+ | ++++ | ++ |
Aktivierung von NK-Zellen / Antikörper-vermittelte zelluläre Zytotoxizität(ADCC) |
+++ |
- | +++ | +/- |
Komplementfixierung |
++ |
+ | +++ | - |
Protektive Rolle von Antikörper-Effektorfunktionen bei COVID und anderen Infektionen
Ob und wieweit IgG4 zur Abwehr einer Virusinfektion optimal ist, ist unklar. Generell ist es sicher keine IgG-Subklasse, die man gezielt induzieren wollen würde, eben aufgrund der verminderten Effektorfunktionen. Bei Pathogenen, für die Phagozytose, Komplement-vermittelte Lyse oder Opsonisierung eine wichtige Rolle spielen, dies trifft z.B. auf viele bakterielle Erreger zu, wäre eine IgG4-basierte Impfantwort sicher absolut zu vermeiden. Dies könnte auch zu Problemen für die Entwicklung von mRNA-basierten Impfstoffen in diesem Bereich führen. Andererseits war die Induktion von IgG4 bei einem Malariaimpfstoff mit Protektion assoziiert.21 Ebenso ist IgG4 gegen das Denguevirus mit Protektion gegen Denguefieber assoziiert, dem Paradebeispiel für antikörpervermittelte Verstärkung der Infektion, wozu IgG4 durch schwächere Bindung an Fc-Rezeptoren vermutlich nur vermindert in der Lage ist.22
Es ist also sicher nicht generell gerechtfertigt, IgG4 als untauglich für eine antivirale Immunantwort anzusehen, in manchen Fällen ist es sogar möglicherweise überlegen. Vielmehr ist entscheidend, welche Effektorfunktionen der IgG Antikörper, neben der direkten Neutralisation des Virus, eine Rolle beim Schutz vor der jeweiligen Erkrankung spielen. Hier fehlen zu SARS-CoV-2 eindeutige Studien; während es unzählige Veröffentlichung zur Neutralisation von SARS-CoV-2 gibt, auch weil diese schnell und billig zu realisieren sind, sind deutlich aufwendigere Arbeiten, die ein mechanistisches Korrelat der Protektion bei Effektorfunktionen zu identifizieren versuchen, eher schwer zu finden. Die vorhandenen Studien in Tiermodellen weisen allerdings darauf hin, dass Effektorfunktionen durchaus auch eine entscheidende Rolle spielen können,16 so wirkt beispielsweise der monoklonale Antikörper S309-LS, der auch klinisch eingesetzt wird, im Tiermodell eindeutig über Effektorfunktionen gegen Omikronvarianten, bei denen Neutralisation nicht mehr voll gegeben ist.23
Antikörper-Effektorfunktionen als Pathomechanismus bei COVID
Auf der anderen Seite ist es so, dass schwere COVID-Verläufe von einer Überreaktion des Immunsystems geprägt sind, dies ist klar belegt durch die Wirksamkeit von Glukokortikoiden bei schweren Verläufen.24 Eine starke Aktivierung des Komplementsystems, u.a. vermittelt durch Immunkomplexe aus viralen Antigenen und Antikörpern, wird in zahlreichen Studien beschrieben, Komplementaktivierung und Aktivierung von neutrophilen Granulozyten wird mit der bei schwerem COVID beobachteten Hyperkoagulation in Verbindung gebracht.25–27 Inhibition des Komplementsystems führte in mehreren Studien zu signifikant erhöhtem Überleben und vermindert sowohl die Entzündung als auch die COVID-typische Hyperkoagulation.28–30
In nicht-menschlichen Primaten wurde gezeigt, dass es bei Infektion mit dem ursprünglichen SARS-Coronavirus zur akuten Schädigung der Lunge durch Makrophagen kommt, die durch Virus-spezifische Antikörper aktiviert werden, und dass diese Aktivierung sich durch Blockade von Fc-Rezeptoren inhibieren lässt.31 Aktivierung von Fc-Rezeptoren und Komplementaktivierung sind wiederum genau die Effektorfunktionen, welche IgG4 nur vermindert oder gar nicht aufweist, bzw. inhibiert. Von daher scheint eine positive Wirkung einer vermehrt IgG4-basierten Antikörperantwort gegen schwere Verläufe in der späten Erkrankungsphase durchaus wahrscheinlich, wenn auch vielleicht nicht in der frühen Erkrankungsphase bevor inflammatorische Prozesse in den Vordergrund rücken.
Bisher hoher Schutz vor schweren Krankheitsverläufen durch mRNA-Impfstoffe
Die mRNA-basierten Impfungen haben bisher eine hohe Wirksamkeit gegen schwere COVID-Verläufe aufgewiesen.32 Auch gegen Omikronvarianten, gegen welche die Neutralisation, also der bei IgG4 hauptsächlich verbleibende Wirkmechanismus, stark vermindert oder nicht mehr gegeben war, haben die mRNA-basierten Impfungen noch einen hohen Schutz gegen schwere Erkrankung gewährt.32 Es ist also davon auszugehen, dass zumindest die im bisherigen Ausmaß beobachtete Induktion von IgG4 kein Problem darstellt. mRNA-basierte Impfstoffe induzieren zudem neben Antikörpern eine zytotoxische T-Zellantwort, die infizierte Zellen eliminieren kann.33 So wurde durch eine dritte und auch noch zusätzlich durch eine vierte Dosis eines noch gegen das ursprüngliche Virus gerichteten mRNA Impfstoffs eine weitere Erhöhung des Schutzes vor COVID-bedingter Hospitalisierung während der BA.5 Welle gezeigt, wenn auch nur ein geringer Schutz vor symptomatischer Infektion.32 Ob allerdings eine weitere Verschiebung der IgG-Subklassen hin zu IgG4 durch weitere mRNA-basierte Impfungen und Antigenkontakte als günstig oder ungünstig zu sehen ist, sollte durch Studien geklärt werden.
Fazit
Die Induktion eines vermehrten Klassenwechsels hin zu IgG4 durch mRNA-basierte Impfstoffe ist zumindest unerwartet. Bis die langfristige Bedeutung dieses Klassenwechsels klar ist, ist ein weiteres, genaues Beobachten der Entwicklung sicher angezeigt. Andere, mittlerweile verfügbare Impfstoffe wie adjuvantierte Proteinimpfstoffe auf Basis des Spikeproteins oder inaktivierte, adjuvantierte Ganzvirusimpfstoffe stellen eine gute Alternative für die Grundimmunisierung dar, die man, wie auch von der STIKO empfohlen, nutzen kann. Auch als Booster sind mittlerweile adjuvantierte Proteinimpfstoffe zugelassen.34,35 Festzuhalten bleibt allerdings, dass die mRNA-Impfstoffe unter realen Bedingungen eine hohe Wirksamkeit gegen schwere Erkrankung bei gutem Sicherheitsprofil gezeigt haben und zeigen, während die Erwägungen zu etwaigen nachteiligen Folgen einer vermehrt IgG4-basierten Immunantwort bisher theoretischer Natur sind.
Referenzen
1. Irrgang, P. et al. Class switch toward noninflammatory, spike-specific IgG4 antibodies after repeated SARS-CoV-2 mRNA vaccination. Sci. Immunol. 8, eade2798 (2023).
2. Antikörper und Impfung: Wie Wissenschaft von Impfgegnern missbraucht wird - WELT. DIE WELT https://www.welt.de/wissenschaft/plus243241207/Antikoerper-und-Impfung-Wie-Wissenschaft-von-Impfgegnern-missbraucht-wird.html (2023).
3. Corona-Impfstoff ruft verstärkt IgG4-Antikörper hervor. AerzteZeitung.de https://www.aerztezeitung.de/Medizin/Corona-Impfstoff-ruft-verstaerkt-IgG4-Antikoerper-hervor-435388.html (2022).
4. Dingermann, Theo. IgG4-Antikörper: Was bedeutet der Klassenwechsel nach wiederholter mRNA-Impfung? Pharmazeutische Zeitung online https://www.pharmazeutische-zeitung.de/was-bedeutet-der-klassenwechsel-nach-wiederholter-mrna-impfung-137612/seite/2/.
5. Buhre, J. S. et al. mRNA vaccines against SARS-CoV-2 induce comparably low long-term IgG Fc galactosylation and sialylation levels but increasing long-term IgG4 responses compared to an adenovirus-based vaccine. Front. Immunol. 13, (2023).
6. Maslinska, M., Dmowska-Chalaba, J. & Jakubaszek, M. The Role of IgG4 in Autoimmunity and Rheumatic Diseases. Front. Immunol. 12, (2022).
7. Valenzuela, N. M. & Schaub, S. The Biology of IgG Subclasses and Their Clinical Relevance to Transplantation. Transplantation 102, S7 (2018).
8. Laffleur, B. et al. Immunoglobulin genes undergo legitimate repair in human B cells not only after cis- but also frequent trans-class switch recombination. Genes Immun. 15, 341–346 (2014).
9. Trampert, D. C., Hubers, L. M., van de Graaf, S. F. J. & Beuers, U. On the role of IgG4 in inflammatory conditions: lessons for IgG4-related disease. Biochim. Biophys. Acta BBA - Mol. Basis Dis. 1864, 1401–1409 (2018).
10. Kim, W. et al. Germinal centre-driven maturation of B cell response to mRNA vaccination. Nature 604, 141–145 (2022).
11. Walsh, E. E. et al. Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates. N. Engl. J. Med. 383, 2439–2450 (2020).
12. Mateus, J. et al. Low-dose mRNA-1273 COVID-19 vaccine generates durable memory enhanced by cross-reactive T cells. Science 374, eabj9853 (2021).
13. Goh, Y. S. et al. Conserved longitudinal alterations of anti-S-protein IgG subclasses in disease progression in initial ancestral Wuhan and vaccine breakthrough Delta infections. Front. Microbiol. 13, 1043049 (2022).
14. Vidarsson, G., Dekkers, G. & Rispens, T. IgG Subclasses and Allotypes: From Structure to Effector Functions. Front. Immunol. 5, (2014).
15. de Taeye, S. W. et al. FcγR Binding and ADCC Activity of Human IgG Allotypes. Front. Immunol. 11, (2020).
16. Zhang, A. et al. Beyond neutralization: Fc-dependent antibody effector functions in SARS-CoV-2 infection. Nat. Rev. Immunol. 1–16 (2022) doi:10.1038/s41577-022-00813-1.
17. van der Zee, J. S., van Swieten, P. & Aalberse, R. C. Inhibition of complement activation by IgG4 antibodies. Clin. Exp. Immunol. 64, 415–422 (1986).
18. Agrawal, P., Nawadkar, R., Ojha, H., Kumar, J. & Sahu, A. Complement Evasion Strategies of Viruses: An Overview. Front. Microbiol. 8, (2017).
19. Goh, Y. S. et al. Human IgG isotypes and activating Fcγ receptors in the interaction of Salmonella enterica serovar Typhimurium with phagocytic cells. Immunology 133, 74–83 (2011).
20. Freitas Monteiro, M., Papaserafeim, M., Réal, A., Puga Yung, G. L. & Seebach, J. D. Anti-CD20 rituximab IgG1, IgG3, and IgG4 but not IgG2 subclass trigger Ca2+ mobilization and cytotoxicity in human NK cells. J. Leukoc. Biol. 108, 1409–1423 (2020).
21. Chaudhury, S. et al. Delayed fractional dose regimen of the RTS,S/AS01 malaria vaccine candidate enhances an IgG4 response that inhibits serum opsonophagocytosis. Sci. Rep. 7, 7998 (2017).
22. Antibody Fc characteristics and effector functions correlate with protection from symptomatic dengue virus type 3 infection | Science Translational Medicine. https://www.science.org/doi/10.1126/scitranslmed.abm3151?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed.
23. Case, J. B. et al. Resilience of S309 and AZD7442 monoclonal antibody treatments against infection by SARS-CoV-2 Omicron lineage strains. Nat. Commun. 13, 3824 (2022).
24. RECOVERY Collaborative Group et al. Dexamethasone in Hospitalized Patients with Covid-19. N. Engl. J. Med. 384, 693–704 (2021).
25. Conway, E. M. & Pryzdial, E. L. G. Complement contributions to COVID-19. Curr. Opin. Hematol. 29, 259 (2022).
26. Java, A. et al. The complement system in COVID-19: friend and foe? JCI Insight 5, e140711.
27. Afzali, B., Noris, M., Lambrecht, B. N. & Kemper, C. The state of complement in COVID-19. Nat. Rev. Immunol. 22, 77–84 (2022).
28. Lim, E. H. T. et al. Anti-C5a antibody vilobelimab treatment and the effect on biomarkers of inflammation and coagulation in patients with severe COVID-19: a substudy of the phase 2 PANAMO trial. Respir. Res. 23, 375 (2022).
29. Vlaar, A. P. J. et al. Anti-C5a antibody (vilobelimab) therapy for critically ill, invasively mechanically ventilated patients with COVID-19 (PANAMO): a multicentre, double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Respir. Med. 10, 1137–1146 (2022).
30. Tsai, C.-L., Lai, C.-C., Chen, C.-Y. & Lee, H.-S. The efficacy and safety of complement C5a inhibitors for patients with severe COVID-19: a systematic review and meta-analysis. Expert Rev. Anti Infect. Ther. 21, 77–86 (2023).
31. Liu, L. et al. Anti–spike IgG causes severe acute lung injury by skewing macrophage responses during acute SARS-CoV infection. JCI Insight 4, e123158.
32. Tseng, H. F. et al. Effectiveness of mRNA-1273 vaccination against SARS-CoV-2 omicron subvariants BA.1, BA.2, BA.2.12.1, BA.4, and BA.5. Nat. Commun. 14, 189 (2023).
33. Lim, J. M. E. et al. A comparative characterization of SARS-CoV-2-specific T cells induced by mRNA or inactive virus COVID-19 vaccines. Cell Rep. Med. 3, 100793 (2022).
34. Robert-Koch-Institut. Epidemiologisches Bulletin 50/2022. (2022).
35. COVID-19-Impfstoffe - Paul-Ehrlich-Institut. https://www.pei.de/DE/arzneimittel/impfstoffe/covid-19/covid-19-node.html.


